我们经常说起肥料里的硝酸,从专业的角度,看看这个酸的特点。
1.物理性质
硝酸是无色、易挥发的液体,有刺激性气味,能与水以任意比例混溶。
2.化学性质
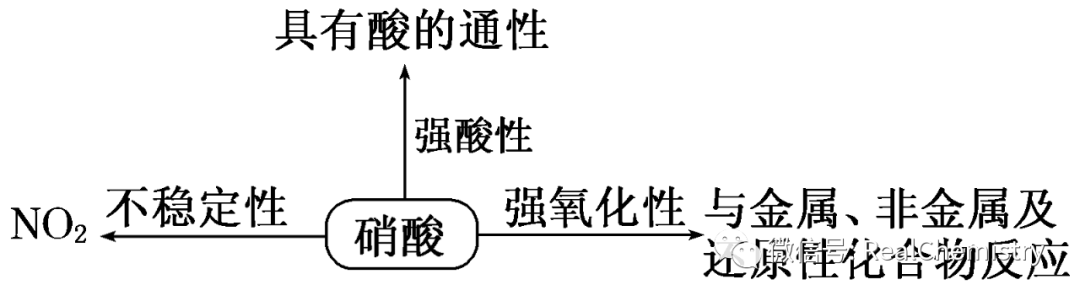
(1)不稳定性:
①反应:4HNO3△2H2O+4NO2↑+O2↑。
②市售浓硝酸呈黄色的原因是:硝酸分解生成的NO2溶解在硝酸里。
③硝酸保存在棕色试剂瓶中,置于冷暗处,不能用橡胶塞。
(2)强氧化性:
不论浓、稀硝酸都有强氧化性,而且浓度越大氧化性越强。
①与金属反应。
稀硝酸与铜反应的化学方程式:
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O。
浓硝酸与铜反应的化学方程式:
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O。
②与非金属反应。
如浓硝酸与C反应的化学方程式:
C+4HNO3(浓)△,CO2↑+4NO2↑+2H2O。
③与还原性化合物反应。
硝酸可氧化H2S、SO2、、HI、Fe2+等还原性物质。
如稀硝酸与FeSO4溶液反应的离子方程式为:
3Fe2++4H++NO3-===3Fe3++NO↑+2H2O。
考察点1浓、稀硝酸氧化性比较
1.由铜与硝酸反应的化学方程式知,浓硝酸被还原为NO2,氮元素的化合价变化为+5→+4;稀硝酸被还原为NO,氮元素的化合价变化为+5→+2。一般情况下,硝酸的浓度越小,其还原产物的价态越低。
2.实验证明,硝酸浓度越大,得电子的能力越强,因而其氧化能力越强。如稀硝酸能将HI氧化为I2,而浓硝酸可将HI氧化为HIO3。
6HI+2HNO3(稀)△3I2+2NO↑+4H2O
HI+6HNO3(浓)△HIO3+6NO2↑+3H2O
3.硝酸在氧化还原反应中,其还原产物可能有多种价态的物质:+4NO2、HN+3O2、+2NO、+1N2O、0N2、-3NH3等,这取决于硝酸的浓度和还原剂还原性的强弱。除前面的实例外,锌与硝酸可发生如下反应:
4Zn+(稀)===4Zn(NO3)2+N2O↑+5H2O
4Zn+(极稀)===4Zn(NO3)2++3H2O
4.硝酸与金属反应的规律:
(1)HNO3与金属反应不能产生H2。
(2)还原产物一般为HNO3(浓)→NO2,HNO3(稀)→NO;很稀的硝酸还原产物也可能为N2O、N2或。
(3)硝酸与金属反应时既表现氧化性又表现酸性。
考察点2硝酸与金属反应的计算
1.思维流程
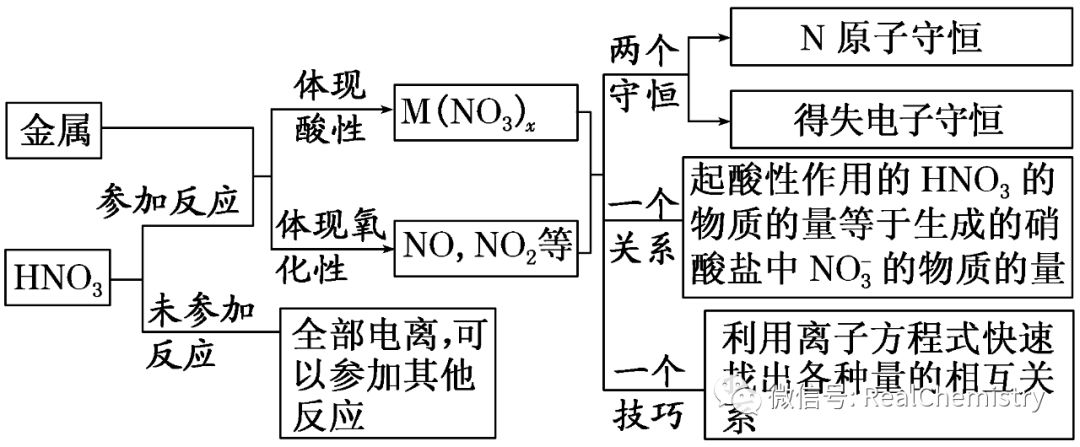
2.计算中守恒思想的应用
(1)原子守恒法:
HNO3与金属反应时,一部分HNO3起酸的作用,以NO3-的形式存在于溶液中;一部分作为氧化剂,转化为还原产物。这两部分中氮原子的总物质的量等于反应消耗的HNO3中氮原子的物质的量。
(2)得失电子守恒法:
HNO3与金属的反应属于氧化还原反应,HNO3中氮原子得电子的物质的量等于金属失电子的物质的量。
(3)电荷守恒法:
HNO3过量时反应后溶液中(不考虑OH-)则有:
c(NO3-)=c(H+)+nc(Mn+)(Mn+代表金属离子)。
(4)离子方程式计算法:
金属与H2SO4、HNO3的混合酸反应时,由于硝酸盐中NO3-在H2SO4提供H+的条件下能继续与金属反应,因此此类题目应用离子方程式来计算,先作过量判断,然后根据完全反应的金属或H+或NO3-进行相关计算,且溶液中要符合电荷守恒。
来源 高中化学
1、本站发布的内容部分购买于网络,仅供读者学习与参考,如有侵权,请联系站长进行删除处理。
2、本站一切资源不代表本站立场,不代表本站赞同其观点和对其真实性负责。
3、本站仅分享资源,以极低的价格降低大家被割韭菜的损失。本站无法保证资源质量,所以介意的小伙伴请勿下单!
4、资源大多存储在云盘,如发现链接失效,请联系站长第一时间更新。